李家洋院士团队长期从事独脚金内酯的合成及信号转导研究,发现独脚金内酯能够诱导其受体D14 与F-box 蛋白D3/MAX2 以及抑制蛋白D53/SMXL2,6,7,8 形成复合体,启动信号转导,诱导D53/SMXL2,6,7,8 发生泛素化修饰介导的蛋白降解,解除对下游基因的转录抑制,调控植物株型以及作物产量(Lin et al., 2009, Plant Cell; Jiang et al., 2013, Nature; Wang et al., 2015, Plant Cell; Song et al., 2017, Cell Research; Duan et al., 2019, PNAS; Wang et al., 2020, Plant Cell)。
然而目前仅有少量独脚金内酯早期响应基因得到鉴定,远不足以解释独脚金内酯在植物生长发育多个方面的重要调控作用;独脚金内酯的人工合成类似物rac-GR24 激活独脚金内酯和karrikin 两条信号途径,导致已鉴定的响应基因不一定位于独脚金内酯信号途径中。
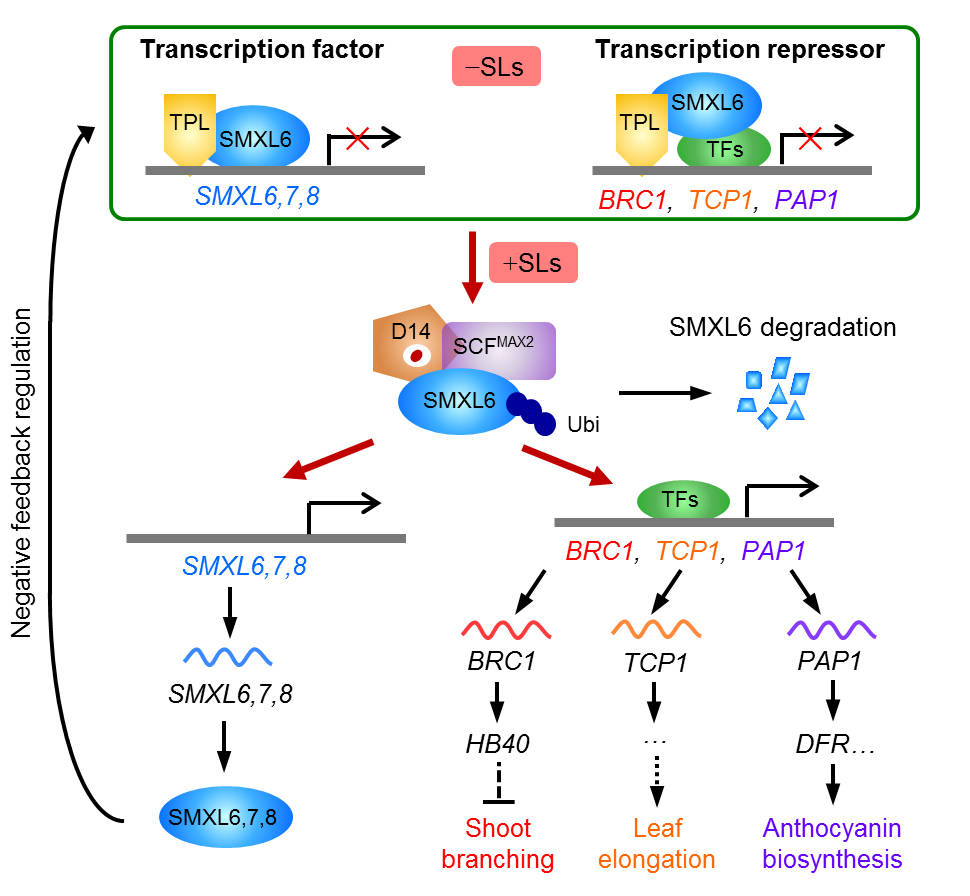
为突破独脚金内酯信号转导研究的瓶颈,研究团队合成了GR24 的对映异构体,发现GR244DO 能够特异性激活拟南芥中独脚金内酯信号通路,以依赖于独脚金内酯受体D14 的方式调控下游基因表达,并系统鉴定了401 个独脚金内酯早期响应基因。发现独脚金内酯通过激活BRC1 的表达上调HB40 的表达水平,进而提高侧芽中植物激素脱落酸(ABA)的含量,抑制分枝发育;通过激活TCP1 的表达促进叶片伸长;通过激活PAP1、PAP2、MYB113 和MYB114 的表达,上调花青素合成基因DFR、ANS 和TT7 的表达,促进花青素的合成与积累。
已有研究表明,在生长素、赤霉素、茉莉素和独脚金内酯等依赖于泛素降解系统的激素信号通路中,抑制蛋白不能直接结合DNA,通过结合转录因子并抑制转录因子的转录活性,阻遏激素响应基因的表达。
该团队发现SMXL6 能够直接结合SMXL6,7,8 基因的启动子并抑制它们的转录,SMXL7 启动子的ATAACAA 基序对于SMXL6 结合SMXL7 启动子并抑制其转录至关重要。SMXL7 能直接结合SMXL6,7,8基因的启动子,SMXL8 也可直接结合SMXL7 的启动子,说明SMXL6,7,8 能够作为转录因子直接结合DNA 并负调控自身编码基因的转录,从而维持自身的稳态和适度的SL 信号响应。同时SMXL6,7,8 能够作为转录抑制蛋白发挥功能,通过招募转录因子并抑制转录因子的转录活性,阻遏独脚金内酯早期响应基因的转录,调控分枝伸长等发育过程。因此,SMXL6,7,8 是具有转录因子和抑制蛋白双重功能的新型抑制蛋白。
![]()
独脚金内酯信号转导新机制
该研究工作是植物激素信号转导领域的突破性进展,提出了一种全新的植物激素信号转导机制,为探索激素作用机理提供了新思路,具有重要的科学意义。研究揭示了独脚金内酯信号通路中的转录调控网络,绘制了独脚金内酯信号通路的全景图,为全面解析独脚金内酯调控植物生长发育以及环境适应的分子机制奠定了重要基础,对改良作物株型、提高营养利用效率以及培育抗寄生作物具有重要指导意义。
中国科学院遗传与发育生物学研究所王磊博士和王冰副研究员为该论文的共同第一作者,李家洋研究员和王冰副研究员为共同通讯作者。植物激素平台褚金芳博士、南京农业大学熊国胜教授及中国科学院上海有机化学研究所杨军研究员参与了该项研究工作。该研究得到了国家自然科学基金委以及中国科学院青促会的资助。
参考文献
Duan, J.B., Yu, H., Yuan, K., Liao, Z.G., Meng, X.B., Jing, Y.H., Liu, G.F., Chu, J.F., and Li, J.Y. (2019). Strigolactone promotes cytokinin degradation through transcriptional activation of CYTOKININ OXIDASE/DEHYDROGENASE 9 in rice. P Natl Acad Sci USA 116, 14319-14324.
Jiang, L., Liu, X., Xiong, G.S., Liu, H.H., Chen, F.L., Wang, L., Meng, X.B., Liu, G.F.,Yu, H., Yuan, Y.D., et al.(2013). DWARF 53 acts as a repressor of strigolactone signalling in rice. Nature 504, 401-405.
Lin, H., Wang,R.X., Qian, Q., Yan, M.X., Meng, X.B., Fu, Z.M., Yan, C.Y., Jiang, B., Su, Z.,Li, J.Y., et al. (2009). DWARF27, an Iron-Containing Protein Required for the Biosynthesis of Strigolactones, Regulates Rice Tiller Bud Outgrowth. Plant Cell 21, 1512-1525.
Song, X.G., Lu, Z.F., Yu, H., Shao, G.N., Xiong, J.S., Meng, X.B., Jing, Y.H., Liu, G.F., Xiong, G.S., Duan, J.B., et al.(2017). IPA1 functions as a downstream transcription factor repressed by D53 instrigolactone signaling in rice. Cell Res 27, 1128-1141.
Wang, L.,Wang, B., Jiang, L., Liu, X., Li, X.L., Lu, Z.F., Meng, X.B., Wang, Y.H.,Smith, S.M., and Li, J.Y. (2015). Strigolactone Signaling in Arabidopsis Regulates Shoot Development by Targeting D53-Like SMXL Repressor Proteins for Ubiquitination and Degradation. Plant Cell 27, 3128-3142.
Wang, L., Xu,Q., Yu, H., Ma, H., Li, X., Yang, J., Chu, J., Xie, Q., Wang, Y., Smith, S.M., et al. (2020). Strigolactone and Karrikin Signaling Pathways Elicit Ubiquitination and Proteolysis of SMXL2 to Regulate Hypocotyl Elongation in Arabidopsis thaliana. The Plant Cell, tpc.00140.02020.
声明:该文观点仅代表作者本人,搜狐号系信息发布平台,搜狐仅提供信息存储空间服务。